山爭(崢)哥哥與年輕導演文牧野又一次引發了電影圈的大地震,上映9天,《我不是藥神(Dying To Survive)》票房就已經破了20億,其劇中涉及的白血病人的現實問題引起了社會廣泛關注:
一位不速之客的意外到訪,打破了神油店老板程勇的平凡人生,他從一個交不起房租的男性保健品商販,一躍成為印度仿制藥“格列寧”的獨家代理商。收獲巨額利潤的他,生活劇烈變化,被病患們冠以“藥神”的稱號。但是,一場關于救贖的拉鋸戰也在波濤暗涌中慢慢展開......
觀影指南:你該知道這些名詞
鑒于部分粉絲還未觀影,尚普君(ID:ipobank)附一則觀影指南,不涉及劇透:
1、 紙巾:到影片后半段你會聽到周圍的人都在哭
2、 CML:Chronic Myelocytic Leukemia,慢性髓細胞白血病,是我國慢性白血病的主要病種,約占慢性白血病的70%,大多數病例經慢性期、加速期,最后進入急變期轉化為急性白血病而死亡。
3、 仿制藥:在原研藥專利到期后,復制粘貼原研藥,是真藥
與商品名藥在劑量、安全性和效力(strength)(不管如何服用)、質量、作用(performance)以及適應癥(intended use)上相同的一種仿制品(copy),是與原研藥具有相同的活性成分、劑型、給藥途徑和治療作用的藥品。
4、 原研藥/專利藥/創新藥:可以理解為正版藥
凡申請專利的新化學單體藥為專利藥,它研制過程包括發現階段、臨床前開發、新藥臨床前申請(IND)、新藥臨床試驗I期、新藥臨床試驗Ⅱ期、新藥臨床試驗Ⅲ期、新藥申請(NDA)。這些藥品只有擁有這些專利藥品的公司才能生產,或由他們自己轉讓別人生產。
5、 一致性評價:仿制藥一致性評價是指對已經批準上市的仿制藥,按與原研藥品質量和療效一致的原則,分期分批進行質量一致性評價,就是仿制藥需在質量與藥效上達到與原研藥一致的水平。美國FDA規定,仿制藥必須和它仿的專利藥在“有效成分、劑量、安全性、效力、作用(包括副作用)以及針對的疾病上都完全相同”。
6、 格列衛:電影中稱為格列寧,是甲磺酸伊馬替尼的商品名,是國際醫藥巨頭諾華公司研發的針對慢性粒細胞白血病(CML)的小分子靶向藥。伊馬替尼的出現顛覆了傳統的治療方案,使患病者5 年生存率達到93%,相比于最初的治療方案馬利蘭等,患者生存率顯著提升。對于患者而言,伊馬替尼成為維系生命的必需品。
原研藥上市:高投入高風險長周期
劇中的矛盾,主要源自于原研藥格列寧的定價過高,而普通大眾由于需長期服用,因買藥很容易傾家蕩產。
原研藥之所以定價如此高昂,用一句俗語來解釋就是“第一粒藥品的價格是50億美元,第二粒藥品的價格只有5美元”。原研藥的研發周期長達十幾年,資金投入十分巨大,且研發失敗率高,一旦失敗,顆粒無收。
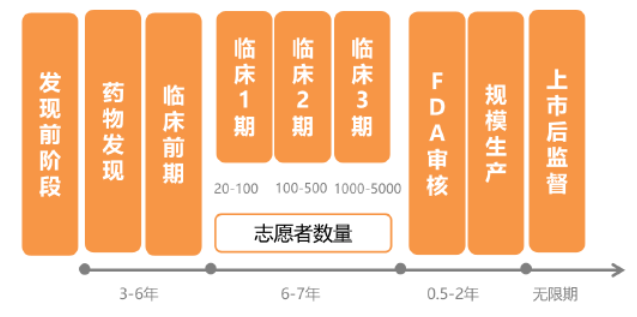
國際制藥巨頭每年都投入上百億美元的研發費用,例如輝瑞制藥,2017年,其營業收入達到525億美元,其中光研發投入就有76億美元,占到收入的15%。新基醫藥2017年營收130億美元,研發投入59億美元,占到45%。可氣的是,高投入并不一定有高回報,藥物研發成功的概率奇低,腫瘤藥物又格外突出,整體成功率僅有5%。商人不是慈善家,在這種背景下,如果沒有專利期保護政策,將沒有醫藥企業愿意進行如此耗精力的藥物研發活動。
仿制藥:印度成全球藥房
程勇為呂受益等白血病人代購的國家,就是印度,是出了名的仿制藥生產大國。
仿制藥概念始于1984 年的美國“Hatch-Waxman 法案”,法案規定,只要新廠家證明自己的產品與原研藥生物活性相當便可仿制。而印度仿制藥如此發達,主要歸因于印度政府的支持。
1960 年剛成立的蘭伯西(Ranbaxy)仿制羅氏的鎮定劑苯甲二氮Valium,為窮人提供了新的購藥渠道,解決了印度好藥匱乏的問題。
1970年印度政府出臺《專利法》,將原有的產品專利保護轉變為工藝專利保護;規定"只保護制藥工藝,不保護藥品成分",對食品、藥品等只授予工藝專利,不授予產品專利,使印度制藥企業可以合法仿制跨國醫藥企業的原研藥。
1994 年,印度簽署了《與貿易有關的知識產權協定》(TRIPS 協議)。協議給予了發展中國家10 年過渡期。在這一時期內,印度接受醫藥產品專利申請,但仍不授予醫藥產品專利保護。印度藥企逐漸確立了競爭優勢,并開始進入國際市場。
2005年之后,專利制度逐漸與國際接軌,本土企業專利制度優勢減弱,促進了本土醫藥企業創新與研發,跨國合作加速。2012 年,印度發布了《生物制劑類似物標準指南》,對質量,流程與試驗審批等做出了規范。
中國政府在努力:解決天價藥問題
2015 年以前,我國藥政監管領域面臨諸多積弊,藥品審評批件積壓現象嚴重,藥品上市周期過長,許多同類靶點藥物與發達國家上市時間相隔5-10 年,導致臨床需求遠遠得不到滿足。
2015 年以來,《國家食品藥品監督管理總局關于開展藥物臨床試驗數據自查核查工作的公告》打響藥政改革的第一槍,政府逐步對藥品準入監管進行了全方位的改革和制度化構建。
2016 年3 月,國務院辦公廳發布《關于開展仿制藥質量和療效一致性評價的意見》,對于已經通過一致性評價的品種,在醫保支付、招標過程中享受政策紅利,在江蘇、山東、四川等多個省份“通過一致性評價的品種”與原研分到了一個競價分組,以期可以替換原研藥或者促進原研藥降價。
2017 年10 月,國務院《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》的出爐以及后續《藥品管理法》修正案、《藥品注冊管理辦法》兩個征求意見稿的出臺,從頂層設計的角度對接下來的藥政改革進行了方向性的指導。
2017 年我國醫保目錄在歷時8 年后,再次進行了調整。新版醫保目錄擴大了基本醫療保險用藥保障范圍,中成藥、西藥部分共收載藥品2535 個,相較于2009 年,新版醫保目錄新增339個品種,關注兒童用藥和重大疾病用藥,增加職業病特殊用藥等,電影中所指的格列衛正是在這次醫保目錄調整中進入的國家醫保。
同時,為了進一步加大高價值藥品的覆蓋,對于更多的臨床價值高的新藥等采取國家談判的方式。2016 年和2017 年分別由衛計委和人社部開展了兩次國家醫保目錄談判,通過談判降價的方式納入這些高臨床價值的藥品。
中國醫藥行業:仿制藥還是原研藥?
仿制藥的存在,一方面為普通民眾提供了價格更低但藥效相同的藥物,切實減輕了大眾的患病負擔;但另一方面,在一定程度上降低了藥企研發的積極性,畢竟,只要專利期一過,藥企就可以通過生產仿制藥,憑借極低的成本獲取高額利潤。
但是,真實的臨床需求刺激了創新產品的供給,最終回到需求,本質上是一個螺旋上升的正向循環。CFDA 準入制度的改革和未來醫保動態調整機制的實現從制度的角度打開了循環過程中的瓶頸,從供給和支付端都逐步打開了原研藥的市場,使得整個產業以更快的速度螺旋上升。同時疊加上產業本身從技術層面的日新月異,國內處在轉折點上的醫藥制造業行業屬性正逐步由迭代速度較慢的制造業逐步轉為迭代速度更快的高新技術行業。
至于醫藥行業到底是選擇原研藥還是仿制藥,并不是一個單選題,左手原研,右手仿制,兩手都要抓,兩手都要硬,才能在現階段和以后的日子里,真正的為人民謀福祉。



